前幾天,有個客戶詢問如何提取酵母的RNA,小新當時就推薦了超純總RNA提取試劑盒,這個試劑盒的說明書中就有酵母的提取步驟。之后考慮到通用性極強的高多糖多酚植物總RNA試劑盒是不是效果會更好呢,于是決定實際測試一下。
實驗目的
比較高多糖多酚植物總RNA試劑盒與超純總RNA提取試劑盒提取酵母RNA的效果。
實驗材料
新鮮培養的酵母、研缽、高多糖多酚植物總RNA試劑盒(Simgen Cat.No.5103050)、超純總RNA提取試劑盒(Simgen Cat.No.5003050)
超微量電子天平(DENVER INSTRUMENT,TP-213)
旋渦震蕩器(越新儀器,XH-C)
臺式離心機(eppendorf Centrifuge 5415 D)
超微量分光光度計(Simgen Cat.No.sim100)
電泳儀(北京六一儀器廠,DYY-6C型)
實驗內容
超純總RNA提取試劑盒提取方法:
1. 將培養的酵母菌離心沉淀棄上清液,震蕩懸浮,用移液槍吸取300 mg于研缽中,加入3 ml Buffer TL進行研磨。充分研磨后,吸取2管1.1 ml液體于1.5 ml離心管中。
2. 加入200 μl Buffer EX,旋渦震蕩混勻,12000 rpm離心。
3. 吸取600 μl上層水相于新的1.5 ml離心管中,加入同體積70%乙醇,混勻后分兩次加入核酸純化柱中,離心棄濾液。
4. 在核酸純化柱中依次加入500 μl Buffer WA和600 μl Buffer WBR洗滌。
5. 14000 rpm空離1分鐘去除殘留乙醇。
6.將核酸純化柱放于RNase-Free的1.5 ml離心管中,加入50 μl RNase-Free Water,室溫靜置1分鐘,離心洗脫得到酵母RNA。
高多糖多酚植物總RNA試劑盒提取方法:
1. 將培養的酵母菌離心沉淀棄上清液,震蕩懸浮,用移液槍吸取300 mg于研缽中,加入1.8 ml已加入β-巰基乙醇的Buffer RCT進行研磨。充分研磨后,吸取2管700 μl液體于1.5 ml離心管中。
2. 加入600 μl Buffer EX,旋渦震蕩混勻,12000 rpm離心。
3. 吸取350 μl上清液于新的1.5 ml離心管中,加入同體積Buffer K,混勻后轉移到過濾柱過濾。
4. 在濾液中加入700 μl 70%乙醇,混勻后分兩次加入核酸純化柱中,離心棄濾液
5. 在核酸純化柱中依次加入500 μl Buffer WA和600 μl Buffer WBR洗滌。
6. 14000 rpm空離1分鐘去除殘留乙醇。
7.將核酸純化柱放于RNase-Free的1.5 ml離心管中,加入50 μl RNase-Free Water,室溫靜置1分鐘,離心洗脫得到酵母RNA。
將提取到的RNA在超微量分光光度計上測量濃度和純度,并進行瓊脂糖凝膠RNA電泳檢測。
實驗結果
1. 在超微量分光光度計上用RNase Free Water調零,測量洗脫下來的RNA,結果如下:
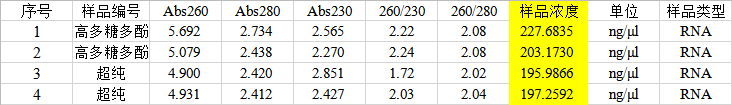
其中1、2為高多糖多酚植物總RNA試劑盒提取的酵母RNA結果,3、4為超純總RNA提取試劑盒提取的酵母RNA結果。
2. 在1%的瓊脂糖凝膠上,加入5 μl提取到的RNA,電泳25分鐘,結果如下:
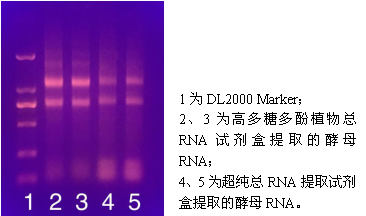
實驗討論與分析
1. 從測得的濃度分析,高多糖多酚植物總RNA試劑盒提取到的RNA濃度稍高一點。再結合電泳分析,高多糖多酚植物總RNA試劑盒提取的RNA條帶相對而言亮度更高,也更清晰,而超純總RNA提取試劑盒提取到的RNA條帶亮度則明顯較暗。因此可以推斷出超純總RNA提取試劑盒提取到的RNA實際濃度可能比分光光度計測的數值更低,可能有較高比例的OD260吸收值其實是由小片段RNA所貢獻(見電泳圖泳道4、5底部)。
2. 綜上所述,雖然兩種試劑盒都可從酵母中提出RNA,且濃度和純度單純從分光光度計上分析都還不錯,但結合電泳分析,高多糖多酚植物總RNA試劑盒在提取酵母RNA上更勝一籌。
3.之前的一篇文章(實測SIMGEN高多糖多酚植物總RNA試劑盒強大的通用性)中介紹過,針對那些高多糖多酚樣本,需要使用高多糖多酚植物總RNA試劑盒,用超純總RNA提取試劑盒提取往往會出現一些問題。而酵母細胞壁的主要成分是甘露聚糖和β-葡聚糖,這兩者都屬于多糖,占了細胞壁干重的60%,這可能是超純總RNA提取試劑盒的提取效果不如高多糖多酚植物總RNA試劑盒的主要原因。延伸開來分析,一些絲狀真菌的細胞壁中如果含較高多糖組分的,也應該選用高多糖多酚植物總RNA試劑盒提取RNA。