一直以來,搞植物研究的同學們對Trizol試劑提取植物RNA詬病不斷,在這樣的背景和需求下,我們特別研發了植物總RNA提取液套裝,套裝中除了植物總RNA提取液外,還包括了Buffer EX(氯仿替代品),RNA沉淀液(異丙醇替代品)以及β-巰基乙醇。真可謂一個套裝在手,提取植物RNA無煩惱!現在我們特別選擇了土豆塊莖(Trizol試劑提取失敗)和桑葉(Trizol試劑提取效率極低)兩個典型樣本實測植物總RNA提取液套裝的效果。
實驗目的:
用植物總RNA提取液套裝從桑葉和土豆塊莖中提取RNA。
實驗材料:
桑樹葉片、土豆塊莖,研缽,植物總RNA提取液套裝(Simgen Cat. No.5123100)
超微量電子天平(DENVER INSTRUMENT,TP-213)
旋渦震蕩器(越新儀器,XH-C)
臺式離心機(eppendorf Centrifuge 5415 D)
超微量分光光度計(Simgen Cat.No.sim100)
電泳儀(北京六一儀器廠,DYY-6C型 )
土豆內參引物(F:ATTGGAAACGGATATGCTCCA/R:TCCTTACCTGAACGCCTGTCA)
2×One Step SYBR Green RT-qPCR Mix(Simgen Cat. No.7405500)
熒光定量PCR儀(ABI7500)
實驗內容:
1. 在研缽中加入約300 mg小塊的土豆塊莖或桑樹葉片,加入1.8 ml已加入β-巰基乙醇的植物總RNA提取液,然后用研磨棒進行研磨,直至組織呈勻漿狀。
2. 吸取700 μl混合液分裝到兩個1.5 ml離心管中(備注:在植物總RNA提取液套裝說明書中步驟1、2要求將植物樣本經液氮磨成粉末狀后再按每管100 mg的量分裝到1.5 ml離心管中,每管再加入600 μl含β-巰基乙醇的植物總RNA提取液)。
3. 加入600 μl Buffer EX,用力混合均勻,13000 rpm離心10分鐘。
4. 小心吸取350 μl上清,轉入一個潔凈的1.5 ml離心管中。
5. 在上清液中加入等體積的RNA沉淀液,蓋上管蓋混合均勻,13000 rpm離心5分鐘。
6. 棄上清,低速離心數秒使管壁上的上清液聚集到管底,用200 μl吸頭吸盡殘留的上清液。
7. 加入1 ml 70%乙醇,蓋上管蓋,旋渦震蕩懸浮RNA沉淀,13000 rpm離心3分鐘。
8. 棄上清,蓋上管蓋,低速離心數秒使管壁上的乙醇沉降到管底,用200 μl吸頭吸盡殘留的乙醇,保留管底及管壁的白色RNA沉淀。室溫靜置5分鐘干燥RNA。
9. 根據RNA沉淀量加入適量RNase-free水(土豆塊莖樣本50 μl,桑葉樣本200 μl)旋渦震蕩溶解RNA,在超微量分光光度計上測量RNA的濃度,然后進行瓊脂糖凝膠電泳。
10. 按照2×One Step SYBR Green RT-qPCR Mix的說明書操作,對提取到的土豆RNA進行熒光PCR擴增。
實驗結果:
1. 在微量分光光度計上用RNase-Free Water調零,測量提取好的RNA,結果如下:
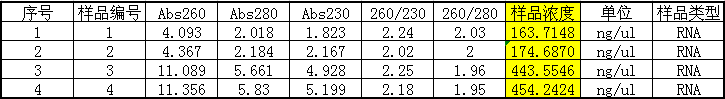
1、2是土豆使用植物總RNA提取液套裝所獲得的總RNA;3、4是桑葉使用植物總RNA提取液套裝所獲得的總RNA。
2. 在1%的瓊脂糖凝膠上,加入5 μl提取到的RNA,電泳20 min,結果如下:

1、2條帶是土豆RNA電泳結果;3、4條帶是桑葉RNA電泳結果,M是DL2000 Marker。
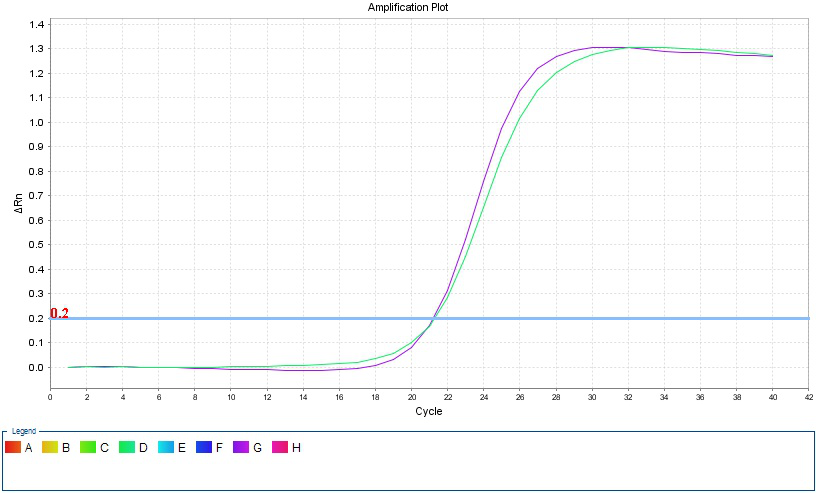
3、土豆RNA熒光PCR曲線圖
實驗討論與分析:
1. 從微量分光光度計測的結果上分析,使用Simgen植物總RNA提取液套裝,不論是土豆塊莖還是桑葉都獲取到了純度非常高的RNA。通常Trizol試劑提取的RNA會出現的A260/A230值偏低的情況也沒有出現。
2. 從電泳圖上分析,RNA條帶完整,有不明顯的基因組DNA污染(土豆RNA)或者根本就觀察不到基因組DNA污染(桑葉RNA),與分光光度計測得的數據有較好的對應關系。
3. 從熒光PCR結果上分析,擴增曲線正常,無抑制現象。
綜上所述,植物總RNA提取液套裝是與Trizol試劑完全不同的產品,不僅不涉及酚氯仿的使用,而且非常適合從高多糖多酚的植物樣本中提取RNA。除此之外,植物總RNA提取液套裝不僅操作步驟比Trizol試劑更為簡單方便,同時又與Trizol試劑一樣,對樣本的用量沒有限制,非常適合一次需要提取非常大量RNA的用戶使用。
Simgen實驗室
2020.08.28