Trizol試劑是基于異硫氰酸胍/酚法的一種即用型的從不同類型的樣本中提取總RNA的試劑,Trizol純化RNA既不限制樣本種類也不限制起始樣本量,是實驗室最常用的RNA純化方法。但是用Trizol試劑純化RNA的不足之處在于需要很長的離心和RNA干燥時間,并且純度通常還比過柱純化獲得的RNA來的更差。
所以在RNA純化柱隨處可得的情況下,自制Trizol柱純化試劑盒不失為提升工作效率和工作質量的好方法。我們來看一下怎么在實驗室自己進行Trizol柱純化吧。
自備試劑:
(1) Trizol試劑
(2) RNA純化柱(購自Simgen RNA純化柱,Cat. No. 7301050)
(3) 70%乙醇
(4) DEPC處理水
實驗儀器與耗材:
(1) RNase-free 1.5 ml離心管和移液器及吸頭
(2) 臺式小量離心機(可配離心1.5 ml離心管和2 ml離心管的轉子)
(3) 液氮與研缽
操作方法:
(1) Trizol 方法操作至離心分相,進入以下操作步驟。
(2) 吸取上層水相轉移到一個潔凈的1.5 ml 離心管中,加入等體積的70%乙醇,勿棄吸頭,直接用吸頭吸注兩次混勻,吸取600 μl混合液轉移到核酸純化柱(核酸純化柱置于2 ml 離心管中)中,蓋上管蓋,12000 rpm 離心30秒。
(3) 棄2 ml 離心管中的濾液,將核酸純化柱置回到2 ml 離心管中,將1.5 ml 離心管中剩余的液體全部加入核酸純化柱中,蓋上管蓋,12000 rpm 離心30秒。
(4) 棄2 ml 離心管中的濾液,將核酸純化柱置回到2 ml 離心管中,在核酸純化柱中加入700 μl 70%乙醇,12000 rpm 離心30秒(最好重復洗滌一次)。
(5) 棄2 ml 離心管中的濾液,將核酸純化柱置回到2 ml 離心管中,14000 rpm 離心1分鐘。
(6) 棄2 ml 離心管,將核酸純化柱置于一個RNase-free的1.5 ml離心管中,在純化柱中加入50 -100 μl DEPC處理水,蓋上管蓋,室溫靜置1分鐘,12000 rpm 離心30秒。
(7) 棄純化柱,洗脫的RNA可立即用于各種分子生物學實驗;或者將RNA儲存于-70℃備用。
使用效果:
用DIY的Trizol柱純化試劑盒提取的大腸桿菌RNA的電泳圖
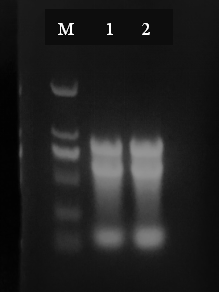
第一條泳道是DL 2000 Ladder Marker,5 μl;
第二、三泳道是Trizol柱純化方法純化的細菌RNA,8 μl。
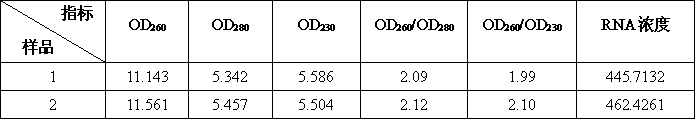
用分光光度計測得的RNA數據:
新景生物實驗室