在高鹽和低pH值的條件下,核酸純化柱中的硅膠膜對核酸有專一性的吸附力,對其他組分如蛋白質、多糖、脂類則基本不吸附,因而能很好地分離純化核酸。質粒純化柱作為核酸純化柱的一種,用于分離提取質粒DNA。質粒純化柱的優劣直接決定質粒DNA試劑盒的性能--那怎么評估質粒純化柱的性能呢?這里就涉及一個質粒純化柱飽和吸附能力的問題,今天我們就設計一個實驗來測試不同質粒純化柱的吸附極限。
在實驗前一天先挑選一種含高拷貝的質粒的細菌進行過夜培養。實驗前先取培養好的3 ml菌液進行質粒DNA提取(步驟參考Simgen 快速質粒DNA小量試劑盒操作說明書),用60 μl Buffer E 洗脫,測量DNA濃度結果如下:

平均3ml獲得質粒DNA的總量是338×60=20,280 ng,即20.28 μg。因此估算得到每毫升菌液大約含有質粒6.7 μg。
接下來是具體的實驗方法:本次實驗選取了實驗室中4種不同的純化柱各2個,分別編號為A(simgen質粒小提中量試劑盒配套使用,標記為1、2)、B(Simgen 快速質粒DNA小量試劑盒配套使用標記為3、4)、C(標記為5、6)和D(標記為7、8)。為了確保純化柱能夠達到飽和吸附,必須使得有充分過量的質粒DNA加入到純化柱中,所以本次實驗中每個純化柱中加入了15 ml菌液中所含質粒DNA的量,考慮到增大菌量后菌體中質粒DNA的釋放效率會有所下降,粗略估計加入純化柱質粒DNA大約在80~100 μg之間。
操作步驟(更詳細的步驟參見simgen質粒小提中量試劑盒)如下:
1、取14個2 ml離心管各收集10 ml菌液;
2、加入500 μl Buffer Ⅰ,充分懸浮;
3、加入500 μl BufferⅡ,溫和翻轉離心管使細菌裂解釋放質粒;
4、加入700 μl Buffer Ⅲ,充分溫和翻轉離心管使其完全中和(沉淀物顏色變為淡黃色),12000 rpm離心10 min
5、將所有上清液混合在一起,用移液槍量取800 μl加入各個純化柱,離心去濾液,重復3次,確保加入過量的質粒DNA用于吸附(此處是重點!!!)
6、依次用500 μl Buffer W1和700 μl Buffer W2進行洗滌
7、純化柱上的質粒DNA用100 μl Buffer E 洗脫
獲得的質粒DNA測量結果如下:
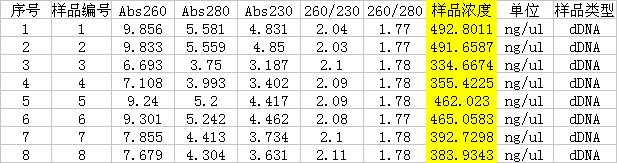
結果顯示,飽和吸附量最高的是質粒純化柱A,平均能夠吸附約49 μg以上的質粒DNA,飽和吸附量最低的是質粒純化柱B,但平均也能吸附約34 μg以上的質粒DNA。
對于質粒純化柱性能的評估,很多廠家沒有進行質粒DNA飽和吸附能力的測試,因此就很難客觀評價純化柱的優劣。實際上純化柱A、B、C、D中加入的質粒DNA在未達到飽和的前提下(比如通常的從1-5 ml 菌液中提取質粒DNA)純化DNA,獲得的質粒DNA濃度差異不大,但是如果加入過量的質粒DNA,差異就體現出來了。
根據我們以往的測試結果來看,國產硅膠膜材質制作的質粒純化柱的飽和吸附能力普遍低于進口的硅膠膜材質(本次實驗測試的質粒DNA純化柱均用進口硅膠膜組裝),所以對純化柱進行飽和吸附能力測試也是一個有參考意義的鑒別的方法。
另外經常做質粒DNA提取的同學也可以回想一下平時提取質粒時的情況,如果使用的是Simgen質粒DNA試劑盒,可能純化柱還有好多吸附空間都白白浪費了。現在有了這個最大吸附飽和度的數據,在實驗中也可以計劃下如何最大限度地利用純化柱的吸附能力;針對一些低拷貝的質粒如果采用多次過柱的方法得到較高的濃度,也是一種不錯的運用哦。
新景實驗室