一、實驗目的:
從火龍果果肉中提取RNA。
二、實驗材料:
新鮮的火龍果、研缽、植物果肉總RNA試劑盒(Simgen,Cat.No.5102050)、植物總RNA提取試劑盒(Simgen,Cat.No.5101050)。
三、實驗方法:
本次實驗嘗試用Simgen的植物果肉總RNA試劑盒和植物總RNA提取試劑盒兩種方法來提取RNA。
四、實驗步驟:
植物果肉總RNA試劑盒提取步驟:
1. 用1.5 ml 離心管稱取500 mg火龍果果肉,加入200 μl 已加入β-巰基乙醇的Buffer RLP,研磨棒研磨至組織完全溶解,再補加300 μl 已加入β-巰基乙醇的Buffer RLP,使最終加入Buffer RLP的總體積為500 μl。混勻后13000 rpm 離心2分鐘;
*由于火龍果果肉容易破碎,本實驗采用研磨棒磨碎果肉。
2. 吸取≤ 700 μl的離心上清到過濾柱中,離心取濾液;
3.向濾液中加入700 μl 70%乙醇,混勻后取700 μl混合液加入到核酸純化柱中,離心去濾液;
4. 將剩余的混合液加入到核酸純化柱中,再次離心棄濾液;
5. 依次用500 μl Buffer WA和600 μl Buffer WBR過柱洗滌;
6. 最高速離心,去除純化柱上殘留的乙醇;
7. 將核酸純化柱置于一個潔凈的RNase-free的1.5 ml離心管中,用50 μl RNase-Free Water洗脫RNA;
8. 在微量紫外分光光度計上測量RNA的濃度;
9. 瓊脂糖凝膠電泳。
植物總RNA提取試劑盒提取步驟:
1. 離心管稱取100 mg火龍果果肉,加入100 μl 已加入β-巰基乙醇的Buffer RLC,研磨棒研磨至組織完全溶解,,再補加500 μl 已加入β-巰基乙醇的Buffer RLC,使最終加入Buffer RLC的總體積為600 μl。
*由于火龍果果肉容易破碎,本實驗采用研磨棒磨碎果肉。
2. 將組織的溶解物全部轉移到過濾柱中,離心取濾液;
3. 向濾液中加入600 μl 70%乙醇,混合后取600 μl混合液加入到核酸純化柱中,離心棄濾液;
4. 將剩余的混合液加入到核酸純化柱中,再次離心棄濾液;
5. 依次用500 μl Buffer WA和600 μl Buffer WBR過柱洗滌;
6. 最高速離心,去除純化柱上殘留的乙醇;
7. 將核酸純化柱置于一個潔凈的RNase-free的1.5 ml離心管中,用50 μl RNase-Free Water洗脫RNA;
8. 在微量紫外分光光度計上測量RNA的濃度;
瓊脂糖凝膠電泳。
五、實驗結果:
1. 在微量紫外分光光度計上用RNase-Free Water調零,測量洗脫下來的RNA,結果如下:
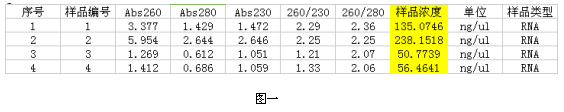
1、2是用植物果肉總RNA試劑盒純化獲得的總RNA;3、4是用植物總RNA提取試劑盒純化獲得的總RNA。
2. 在1%的瓊脂糖凝膠上,加入5 μl提取到的RNA,電泳20 min,結果如下:
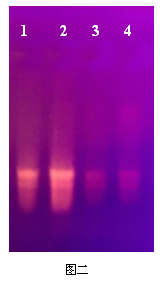
六、討論與分析:
1.從結果上分析用Simgen的植物果肉總RNA試劑盒和Simgen植物總RNA提取試劑盒都能提取到火龍果果肉的RNA。
2.用Simgen植物果肉總RNA試劑盒能夠提取的樣本量是植物總RNA提取試劑盒的5倍,因此提取到的RNA濃度更高。
植物RNA的提取過程經常是Trizol試劑使用者的噩夢,究其原因,無一例外是因為植物組織中多糖(特別是淀粉類物質)衍生物的干擾:因為Trizol試劑中所含的硫氰酸胍遇到多糖類物質便凝結成膠凍狀,阻止了RNA的進一步釋放。當植物組織含有大量水分(比如果肉)時,就是多糖加RNA含量低的雙重阻撓了——這時候選用Simgen果肉總RNA試劑盒提取RNA確實是省時省力的好辦法。
Simgen實驗室