上期我們用Carrier RNA代替病毒測試了病毒樣本保存液和RNA樣本保存液對唾液中病毒RNA的保存效果,發(fā)現(xiàn)兩者差別不大,對唾液中的Carrier RNA均有較好的保護作用。但是Carrier RNA和病毒畢竟還是有差別的,不能按Carrier RNA的測試結果直接推導出病毒樣本測試的結果。下面就讓我們用新冠假病毒(新冠假病毒:將新型冠狀病毒(2019-nCoV,參考序列為NC_045512)的E基因序列合成并克隆構建至慢病毒載體,在293T細胞內進行假病毒的制備。所獲得的假病毒為慢病毒基因組中包含E基因228 base的RNA序列。可以用于病毒RNA提取實驗和qPCR檢測實驗的對照品)來測試一下兩種保存液的效果吧。
一、實驗目的:
對比病毒樣本保存液和RNA樣本保存液對唾液樣本中病毒RNA的保存效果差異。
二、實驗材料:
1. 病毒樣本保存液(Simgen Cat.No.4112100)
2. RNA樣本保存液(Simgen Cat.No.4007020)
3. 新冠假病毒(108 copies/ml)
4. 新鮮采集的人唾液
5. Carrier RNA(Simgen Cat.No.4003101)
6. 2×One Step Probe RT-PCR Mix(Simgen Cat.No.7406100)
7. 新冠病毒特異性引物及探針(F:CCCTGTGGGTTTTACACTTAA/R:ACGATTGTGCATCAGCTGA,Probe:5’-FAM-CCGTCTGCGGTATGTGGAAAGGTTATGG-BHQ1-3’)
8. 電熱恒溫培養(yǎng)箱(上海精宏實驗設備有限公司,DNP-9082)
9. 旋渦震蕩器(越新儀器,XH-C)
10. 臺式離心機(eppendorf Centrifuge 5415 D)
11. 熒光PCR儀(ABI 7500)
三、實驗內容:
用唾液將假病毒稀釋至106 copies/ml,按比例與不同保存液進行混合,然后分成兩份,一份放入37℃恒溫箱中,另一份放入﹣20℃冰箱中,每隔一周提取一次RNA(每種實驗條件重復一管),并進行RT-PCR反應,觀察保存液的保存效果。
RNA樣本保存液:唾液=3:1 | 病毒樣本保存液 :唾液=2:1 |
1. 將混合液上下翻轉混合均勻,吸取100 μl混合液到RNase-free的1.5 ml離心管中,加入300 μl裂解液和1 μl Carrier RNA,旋渦振蕩數(shù)秒混合均勻,室溫靜置10分鐘; 2. 加入320 μl無水乙醇,溫和地翻轉離心管3~5次混合均勻; 3. 稍離,吸取液體到核酸純化柱中,13000 rpm離心30秒,棄濾液; 4. 在核酸純化柱中加入600 μl Buffer WA,離心棄濾液; 5. 在核酸純化柱中加入700 μl Buffer WBR,離心棄濾液; 6. 14000 rpm離心1分鐘去除殘留液體; 7. 將核酸純化柱置于一個RNase-free的1.5 ml離心管中,加入50 μl RNase Free Water,室溫靜置1分鐘,離心洗脫得到RNA。 | 1. 將混合液上下翻轉混合均勻,吸取300 μl混合液到RNase-free的1.5 ml離心管中,13000 rpm離心2 min; 2. 吸取上清到新的1.5 ml離心管中,加入300 μl 70%乙醇和1 μl Carrier RNA,溫和地翻轉離心管3~5次混合均勻; 3. 稍離,吸取液體到核酸純化柱中,13000 rpm離心30秒,棄濾液; 4. 在核酸純化柱中加入600 μl Buffer WA,離心棄濾液; 5. 在核酸純化柱中加入700 μl Buffer WBR,離心棄濾液; 6. 14000 rpm離心1分鐘去除殘留液體; 7. 將核酸純化柱置于一個RNase-free的1.5 ml離心管中,加入50 μl RNase Free Water,室溫靜置1分鐘,離心洗脫得到RNA。 |
8. 用2×One Step Probe RT-PCR Mix、新冠病毒特異性引物及探針配置好反應液,加入5 μl提取的RNA進行RT-PCR反應。 | |
四、實驗結果:
RT-PCR擴增曲線如下:
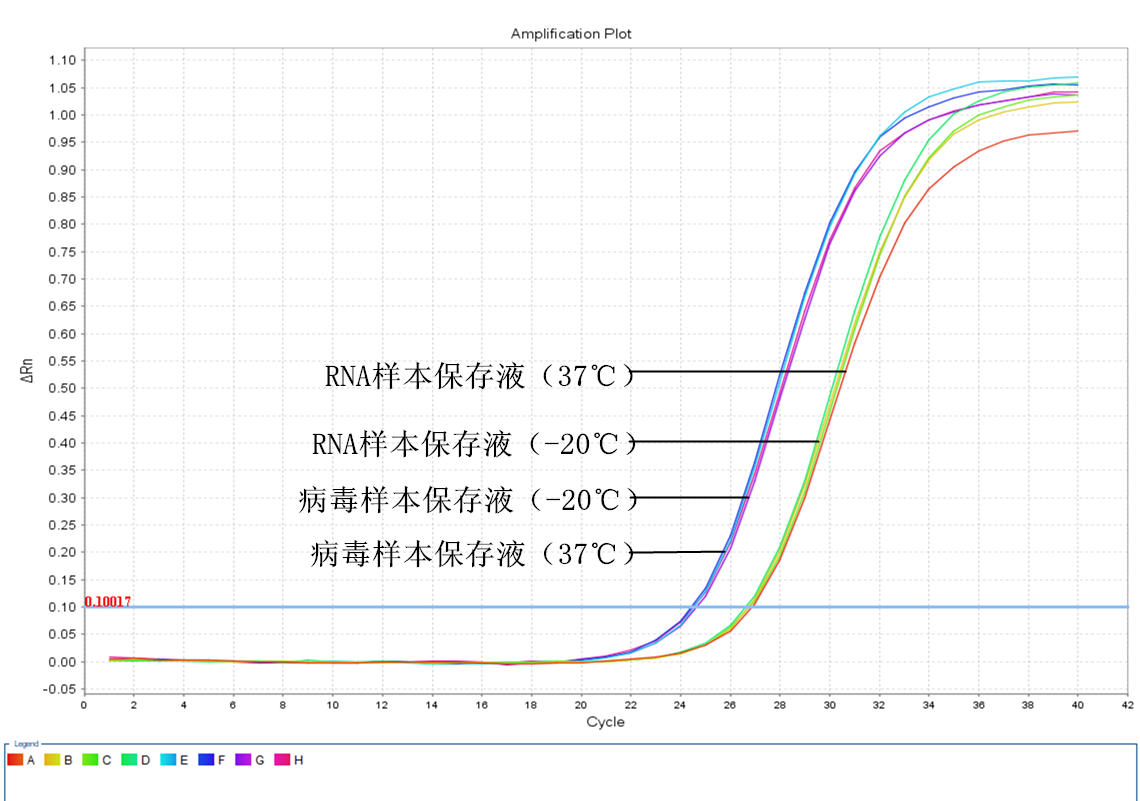
實驗當天

一周后
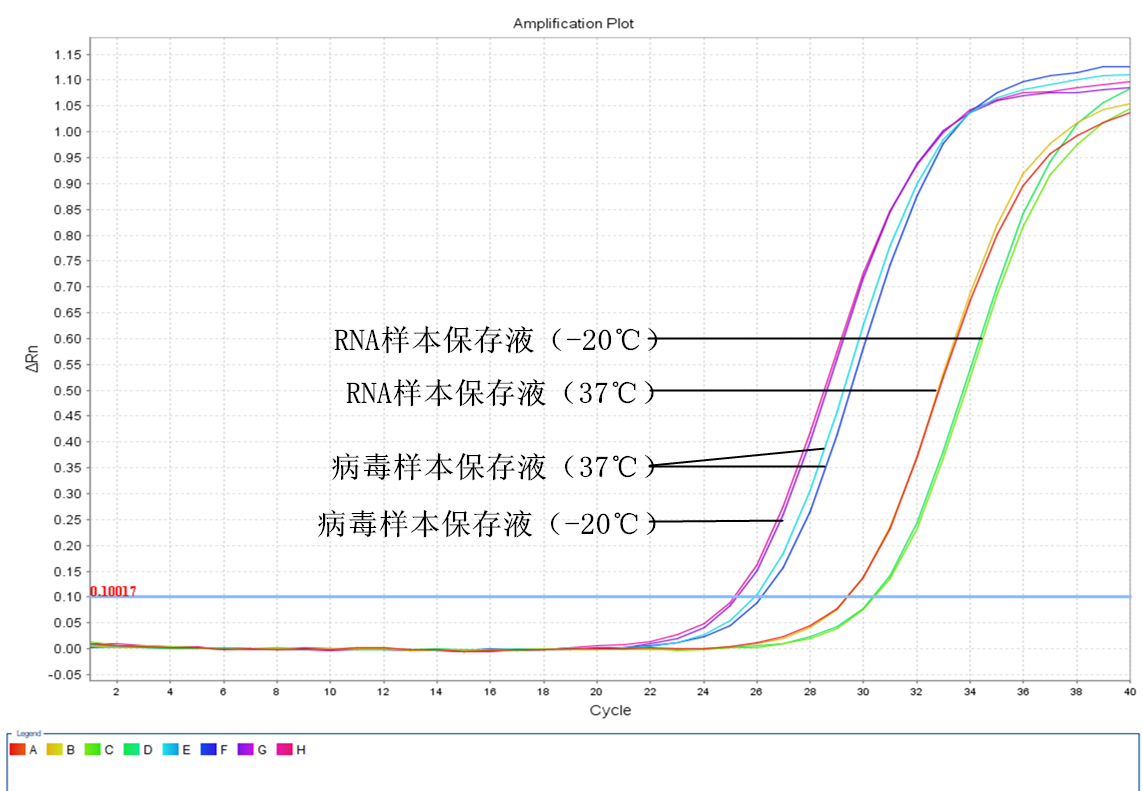
兩周后
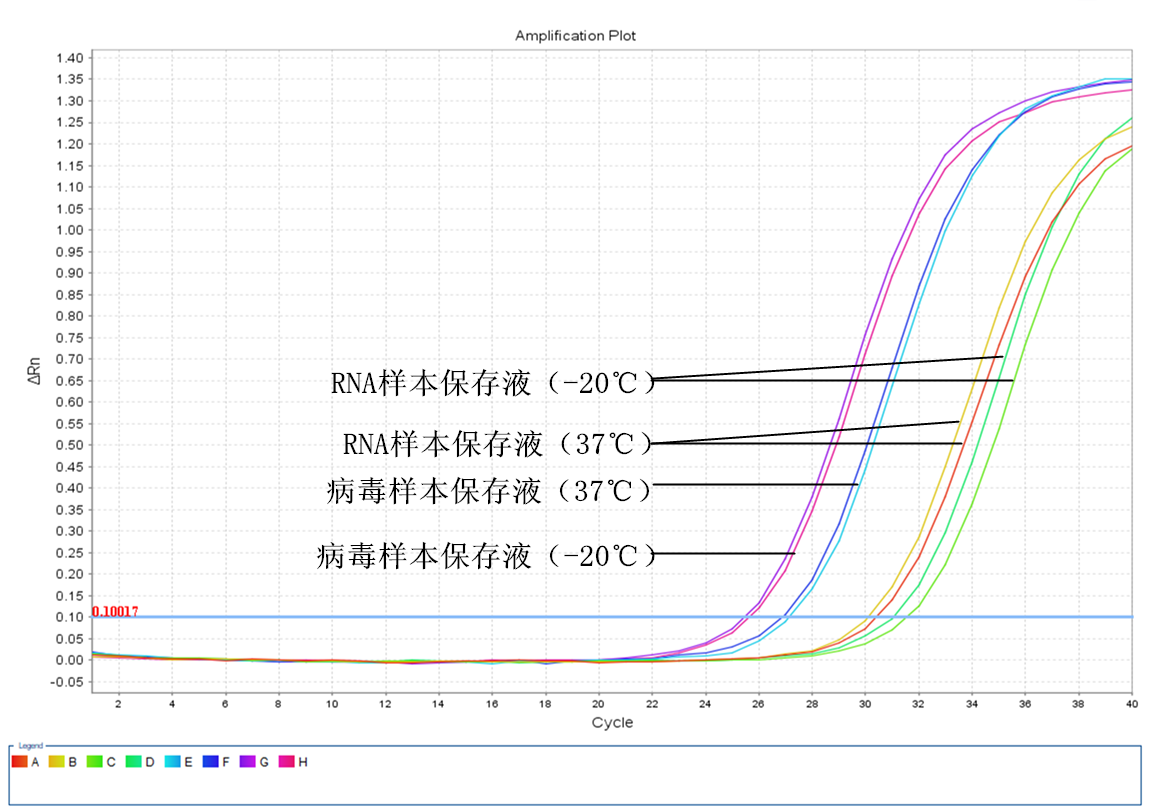
三周后
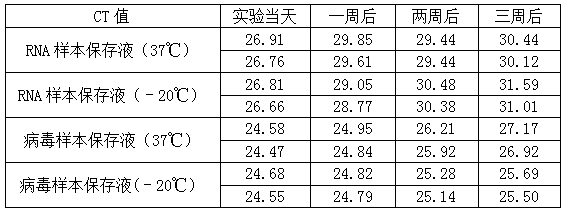
CT值如下:
一、 實驗當天結果分析:討論與分析:
由于病毒樣本保存液起始唾液樣本的用量相當于RNA樣本保存液的4倍,因此提取到的RNA量也相差4倍,這4倍的濃度差相當于2個CT值。而對比實驗當天提取的RNA RT-PCR反應后的CT值,可以發(fā)現(xiàn)RNA樣本保存液保存的樣本的CT值的確比病毒樣本保存液的要大2.2左右,與我們預想的結果相符。
二、 第一周實驗結果分析:
1. RNA樣本保存液保存的唾液樣本在不同溫度下保存一周后,提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較增大了約2.1~2.9個CT值,且37℃和﹣20℃保存的樣本結果差異不明顯。可以推理出樣本中病毒的RNA降解了約75%以上。
2. 病毒保存液保存的唾液樣本在不同溫度下保存一周后,提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較增大了約0.3個CT值,同樣的37℃和﹣20℃保存的樣本結果差異不明顯。即使兩個完全相同的熒光PCR反應體系,在不同孔間反應產生的CT值也會有差異,因此我們推斷病毒保存液保存的病毒RNA降解得很少,或者降解的程度不嚴重,未影響后續(xù)的熒光PCR檢測。
三、 第二周實驗結果分析:
1. RNA樣本保存液保存的唾液樣本在37℃下保存兩周后,提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較仍然是增大了約2.6個CT值,但奇怪的是﹣20℃保存的樣本提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較卻增大了約3.7個CT值。也就是說低溫保存的樣本中的RNA竟然比37℃保存的RNA降解得更嚴重,和我們預想中的結果不符。
2. 病毒樣本保存液的結果與我們預想的一致,﹣20℃保存的效果要比37℃保存的效果更好,但是提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較還是增大了約0.6個CT值,相當于樣本中病毒的RNA已經降解了約33%左右。
四、 第三周實驗結果分析:
1. RNA樣本保存液保存的唾液樣本在37℃下保存三周后,提取的RNA進行RT-PCR反應后的CT值與實驗當天的CT值比較增大了約3.4個CT值,相當于樣本中病毒的RNA已經降解了約90%左右。同第二周一樣,﹣20℃保存的樣本中的RNA比37℃保存的RNA降解得更嚴重。
2. 病毒樣本保存液保存的唾液樣本在37℃下保存三周后,實驗獲得的CT值與實驗當天的CT值比較增大了大約2.5個CT值,相當于80%的病毒RNA已經被降解了,﹣20℃保存的效果第三周和第二周的CT值差別不明顯。
經過上述三周的實驗結果我們得出以下結論:
1. 確實不能按Carrier RNA的測試結果直接推導出病毒樣本測試的結果,病毒RNA似乎比Carrier RNA更容易降解。雖然上次用Carrier RNA測試時推測兩種保存液保存唾液中RNA病毒樣本的效果差不多,但是通過本次實驗測試,卻明確地顯示出病毒樣本保存液保存唾液中RNA病毒樣本的效果優(yōu)于RNA樣本保存液。
2. 用病毒樣本保存液保存唾液病毒RNA樣本,在一周內無論是存放在37℃或者﹣20℃均不影響后續(xù)病毒核酸檢測。隨著時間的延長,﹣20℃存放的RNA樣本顯示出更好的穩(wěn)定性。所以我們用病毒樣本保存液收集了唾液樣本后最好能在一周內提取病毒RNA用于檢測,如果條件允許,盡量將樣本貯存在﹣20℃。
3. 雖然病毒樣本保存液的保存效果更好,但是由于病毒樣本保存液會將病毒顆粒溶解,病毒RNA肯定會處于一個緩慢的降解過程中,否則第二周和第三周測的CT值也不會增大了。那為什么第一周內在CT值上的差異并不明顯呢?我們猜測是一周內的病毒RNA的降解程度尚未影響到病毒RNA作為PCR擴增有效模板的緣故。以本次實驗用的假病毒為例,其RNA長度約為6200 nt,而我們的擴增片段長度僅為119 nt。如果降解后的片段主要是集中在2000-3000 nt,則仍然是遠遠大于擴增片段長度的,就不會對擴增結果有明顯的影響。感興趣的讀者可以看一下之前發(fā)的文章——《模板DNA完整性對PCR結果的影響》,里面有詳細的講解。

·常溫保存1周,37℃保存1天,4℃至少保存1個月,組織4℃浸泡過夜后-20℃或-80℃可長期保存。·反復凍融:凍存于-20℃或-80℃的組織可反復凍融20次而不影響RNA提取的質量。 查看產品

·擁有第一類醫(yī)療器械生產憑證備案憑證,質量得到保證;·滅活病毒,保障使用過程的安全性;·獲得核酸質量好,得率高,并可立即用于下游實驗;·病毒 DNA/RNA 可在常溫(0-30℃)保存與運輸 1 周不降解。 查看產品