之前有個客戶投訴說我們的全血DNA小量試劑盒提取的血液DNA濃度很低,效果不好。小新感覺很奇怪,全血DNA小量試劑盒是我們的明星產品,采用專利技術方法提取的血液DNA,比市場上的血液DNA提取試劑盒操作更加簡便,加上樣本用量大,提取同一個血樣的時候,DNA濃度通常只會更高----于是小新立刻與客戶進行了溝通,經過詳細詢問才發現原來客戶之前經常提取質粒DNA,這次提取血液時怕劇烈操作會弄斷基因組DNA,因此沒有按照說明書寫的劇烈操作,而是溫和地操作。為了驗證是否是這個原因導致提取的DNA濃度低,小新決定實際測試一下。由于Simgen細菌DNA試劑盒同樣采用了全血DNA小量試劑盒的專利技術提取基因組DNA,小新決定先用細菌樣本測試一下。
實驗目的:
測試細菌DNA試劑盒提取過程中劇烈操作與溫和操作對實驗結果的影響。
實驗材料:
過夜培養的DH5α細菌、細菌DNA試劑盒(Simgen Cat. No.3302050)
旋渦震蕩器(越新儀器,XH-C)
臺式離心機(eppendorf Centrifuge 5415 D)
超微量分光光度計(Simgen Cat.No.sim100)
電泳儀(北京六一儀器廠,DYY-6C型 )
實驗內容:
劇烈操作 | 溫和操作 |
1. 用1.5 ml離心管收集3 ml細菌培養物,加入200 μl Buffer TE,旋渦震蕩充分懸浮細菌。 2. 加入100 μl溶菌酶溶液,旋渦震蕩約15秒混勻,37℃水浴30分鐘。 3. 加入225 μl Buffer L1,旋渦震蕩30秒。 | |
4. 加入225 μl Buffer L2,劇烈搖晃離心管3~5次,再旋渦震蕩30秒混勻。 | 4. 加入225 μl Buffer L2,溫和的上下顛倒混勻30秒。 |
5. 13000 rpm離心2分鐘。 6. 將步驟5中的上清液倒入到核酸純化柱中(核酸純化柱置于2 ml離心管中),蓋上管蓋,12000 rpm離心30秒。 7. 棄2 ml離心管中的濾液,將核酸純化柱置回到2 ml離心管中,在核酸純化柱中加入500 μl Buffer WA, 蓋上管蓋,12000 rpm離心30秒。 8. 棄2 ml離心管中的濾液,將核酸純化柱置回到2 ml離心管中,在核酸純化柱中加入600 μl Buffer WB, 蓋上管蓋,12000 rpm離心30秒。 9. 棄2 ml離心管中的濾液,將核酸純化柱置回到2 ml離心管中,14000 rpm離心1分鐘。 10. 棄2 ml離心管,將核酸純化柱置于一個潔凈的1.5 ml離心管中,在純化柱中央加100 μl 37℃溫育的Buffer TE,蓋上管蓋,室溫靜置1分鐘,12000 rpm離心30秒。 11. 洗脫下來的DNA測量濃度并進行電泳檢測。 | |
實驗結果:
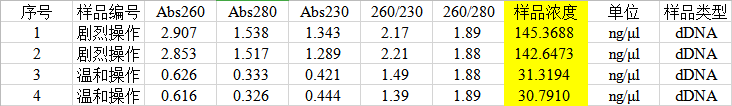
1. 在超微量分光光度計上用Buffer TE調零,測量提取的DNA,結果如下:
2. 在1%的瓊脂糖凝膠上,加入5 μl提取到的DNA,電泳30 min,結果如下:
實驗討析: 
1. 從超微量分光光度計測量的結果上可以看出,劇烈操作提取的DNA濃度是溫和操作提取的4倍以上,Abs260/280幾乎沒有差別,而Abs260/230值劇烈操作提取的DNA更好 。
2. 從電泳圖上可以看到,兩種操作方法提取的DNA電泳的位置差不多,劇烈操作提取的DNA的亮度要明顯亮于溫和操作提取的DNA,與分光光度計測得的數據有較好的對應關系。
大腸桿菌的基因組DNA長度是4.7×106bp,也就是說有接近5000kb的長度,這么長的DNA是非常容易斷裂的(僅僅是用移液器吸取一下DNA溶液就會對DNA有一個剪切的作用),更不用說比細菌基因組DNA更長的人類基因組DNA了。這種斷裂在整個提取過程中都是無法避免的,這就是為什么我們提取到的基因組DNA片段一般都集中在30-50kb的緣故。
Simgen細菌DNA試劑盒沒有使用蛋白酶K消化蛋白,所以更需要劇烈的操作步驟使DNA和蛋白質分離開,否則基因組DNA就伴隨著沉淀物丟失了。我們從電泳圖中也可以發現,溫和操作獲得的基因組DNA長度沒有比劇烈操作獲得的基因組DNA更長;劇烈操作獲得的基因組DNA也沒有非常嚴重的拖尾現象。因此建議大家在提取DNA的過程中一定要按照試劑盒說明書上的要求操作,如果遇到懷疑或不理解的操作步驟可以先和技術支持溝通一下,千萬不要想當然地去更改操作方法,否則結果可能是適得其反。

·15分鐘內即可完成血液總DNA的制備·無須事先分離去除紅細胞及蛋白酶K消化步驟,可室溫運輸儲存·徹底清除血樣中的PCR抑制物,可使用多至1/2反應體系體積的模板進行擴增 查看產品

·專利技術應用,更顯新穎快捷· 無需蛋白酶K和RNA酶消化步驟·特殊設計的蛋白沉淀步驟,確保從過量的細菌中純化DNA時,純化柱也不被堵塞 查看產品